2017年可谓是CAR-T细胞疗法元年,Novartis的Kymriah和Kite(Gilead)的Yescarta两个细胞治疗药物相继在2017下半年被FDA批准,将这一疗法实现产业化,给全球的癌症患者带来了希望。CAR-T药物的异军突起也得到了资本市场及传统药企的广泛关注,自2012年以来涉及CAR-T药物的资本并购总额超过数百亿美金,同时全球超过300多项临床正在进行。
基于CAR-T药物广阔的市场前景,远在大洋彼岸的中国也正在寻求以CAR-T疗法为代表的细胞免疫治疗产业化突破。2017年12月22日,CFDA发布《细胞治疗产品研究与评价技术指导原则(试行)》,为我国细胞治疗产品作为药品属性的规范化产业化生产拉开序幕。截止目前,短短两个月内,在CFDA进行临床试验申请的CAR-T药物即超过13个,同时中国在CAR-T领域的探索性临床研究项目已超过130项,占全球免疫治疗细胞治疗临床研究的1/3,仅次于美国。
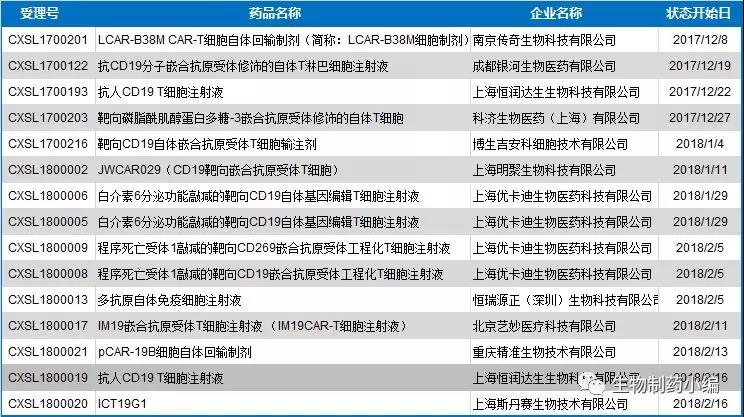
▲ 国内CAR-T药物临床试验申请概况
虽然近几年来,CAR-T药物在安全性和有效性上取得了极大的突破,得以推向市场造福患者,但是居高不下的药品价格(Kymriah:47.5万美元,Yescarta:37.3万美元)仍然让大部分患者望而却步。CAR-T药物生产涉及环节多、生产周期长以及安全性要求高是其售价居高不下的主要原因。而CAR-T药物由于其转化医学的鲜明特点,其产业化道路才刚刚起步,充满无限的挑战,CAR-T药物的研发人员无不感叹CAR-T药物生产技术将是其真正走向产业化最关键的因素。
同时由于CAR-T药物工业化道路才刚刚起步,相关工艺与其它产品相比更为神秘。为了更好的促进CAR-T药物的工业化生产,本文将公布的CAR-T药物生产工艺进行总结,可以看到的是探索中前进的CAR-T药物生产技术将逐步实现生产流程标准化和规范化,更多安全有效的产品将脱颖而出。
探索中前进CAR-T药物生产技术
CAR-T疗法是一种基于整合了CAR基因的自体或异体T细胞疗法,其整个生产工艺流程包括采血、分离、激活、转染、扩增、制剂、放行、运输和给药等一系列过程。
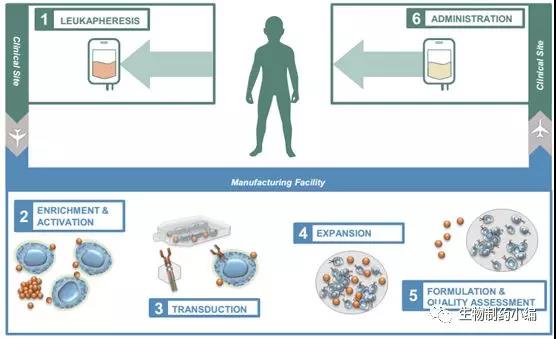
▲ 自体CAR-T药物生产流程
这些生产环节分布于不同机构与组织,通常采血在医院进行,随后采取的外周血发送至生产基地进行核心的CAR-T药物生产,生产放行后的CAR-T药物再进一步通过冷链运输返回至医院供病人注射。对于更常见的自体T细胞疗法,加上质量检测整个生产工艺流程通常为30天左右,这对于处于晚期的病人来说这样的周期长度仍然偏长。各个研发单位基于自身工艺的区别,其生产周期也长短不一,但是生产周期随着技术的技术的进步正在不断缩短。
Kite的工艺更为简便,其生产周期也最短,仅为10天左右。Novartis的生产周期更为复杂一些,其生产周期更长一些达到了29天,虽然Novartis后期进行过一些优化,但仍然有22天。但Novartis生产工艺目前认为是比较标准的CAR-T药物生产工艺,其生产工艺也稳定性也得到了充分的验证,在Novartis关键性的临床试验B2202中的78例病例中,只有6例病人因为生产原因(4例因为T细胞未能成功生长,1例因为药物剂量低于质量标准,1例因为残留磁珠高于质量标准)未能进行药物注射。Juno虽然没有精确公布其生产周期,但是透露也在14-18天左右,同时基于其前期的临床试验结果不太理想,对其生产工艺进行了充分的优化,率先使用了CD4和CD8等比例的T细胞源进行生产,极大地保证了药物的有效性,Juno透露其第三代和第四代技术目标将缩短至3-6天。
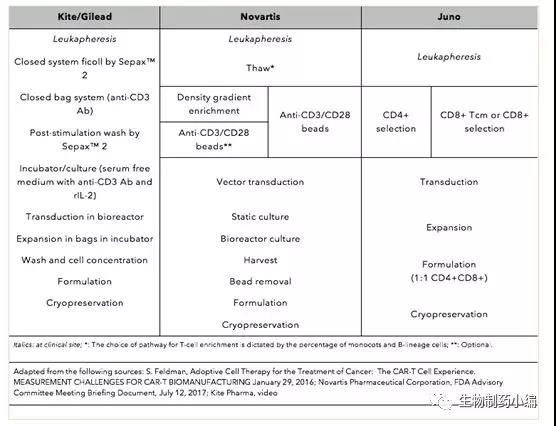
▲ CAR-T药物研发领先企业工艺流程
从目前来看,整个CAR-T药物的生产技术对于仪器的依懒性还是比较高的,也就是选择怎样的生产仪器即决定了怎样的生产工艺。但对于CAR-T药物的生产工艺两项基本原则是:封闭的及可重复的。近年来,各个设备提供商们也极大地推动了自身设备的研发,为每个CAR-T单元生产环节提供解决多种方案。同时还有提供整理解决方案的设备,例如CliniMACS一款仪器可以实现从细胞筛选到最终制剂制备的整个T细胞生产工艺,当然其售价及后期使用价格也更为高一些。但无论基于怎样的设备考量,每个生产环节的目的仍然是一样的。
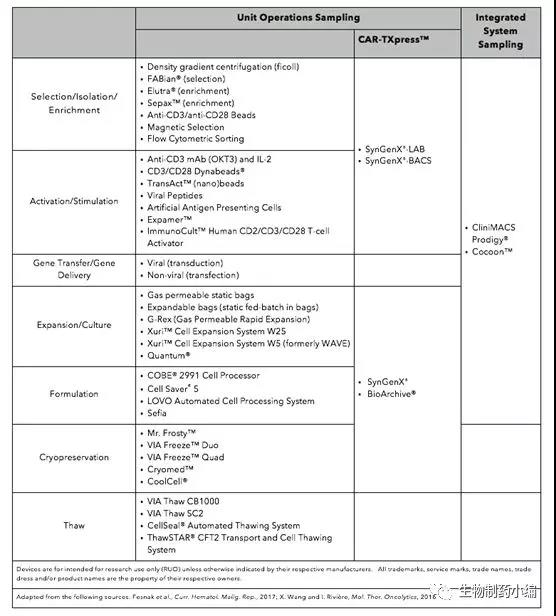
▲ CAR-T药物单元操作流程
首先,T细胞疗法从体内全血中获得患者的白细胞。通常在采集过程中会加入抗凝剂,使用密度梯度介质连续或间断离心法分离血液成分。采集过程中,仍然会有少量红细胞和血小板会残留在收集的白细胞中,红细胞会影响最终T细胞药物的效率,血小板会引起细胞聚团,而抗凝剂有可能会改变细胞的生化特性,因此在采集后的白细胞首先要进行淘洗。Ficoll梯度离心是最常用的分离方式,但是其由于是非封闭的系统逐渐被淘汰。自动淘洗装置COBE 2991 Cell Processor,Haemonetics CellSaver ,Biosafe Sepax II以及CaridianBCT Elutra单细胞采集器等仪器使用越来越常见。
淘洗后的T细胞根据工艺的要求会进一步进行富集,有的需要CD4和CD8等比例,有的需要采集CD56或者CD3阳性的T细胞,目前有通过抗体磁珠、细胞大小或者流式细胞仪等多种特异性的细胞富集方式。
在体内,T细胞主要依靠树突状细胞(DC)等抗原呈递细胞的分化刺激T细胞增殖。通过如CD28、4-1BB,OX40共刺激分子,T细胞被T细胞受体(TCR)与位于DC细胞表面的主要组织相容性复合体相互作用所激活。在体外培养过程中,为了避免与DC同培养的过程的繁琐过程,有几种方法模仿天然T细胞激活过程已经开发并实施。最早方法是抗CD3抗体和IL-2的联合使用,或许又有方法将抗CD3抗体、抗CD8抗体以及IL2三者进行联用激活,接着Invitrogen和Miltenyi分别开发的CD3/CD28抗体磁珠极大地提高了激活效率,目前以抗体磁珠为代表的激活方式占到了60%以上。
T细胞进行激活以后,就需要将其改造成注射到体内的形式,这一步将是整个CAR-T药物生产工艺的核心。目前最常用方式是通过病毒转染方式进行T细胞改造,这其中又以逆转录病毒和腺相关病毒的转染方式更为普遍,两者占到了所有转染方式的90%左右。逆转录病毒技术更为传统,其安全性高和生产成本也更低一些。但腺相关病毒基于其转染效率高的特点,使用比例正在不断增加。同时由于病毒载体的生产和质量控制也极为复杂,目前大多数细胞治疗的病毒载体都是外包生产。基于安全性方面的考虑,转座子电转等一些转染方式也逐渐得到关注,但是其转染效率仍然比较大的限制。另一方面,ZFN、TALEN和CRISPR等一些基因敲除的改造方式也逐步运用到异体T细胞治疗中。
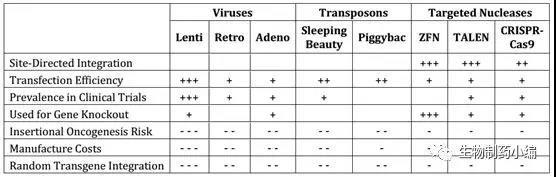
▲ 基因转染方式比较
改造后的T细胞,下一步就需要培养到足够的数量以输送到病人体内,这是整个T细胞药物生产的另一个关键步骤,目前最常用的三种方式为静置的方瓶培养、透气式的培养袋培养以及摆动的反应器培养,这些培养根据最终需要的T细胞数量可以灵活选用合适的培养方式。目前大多数T细胞药物剂量为10e8-10e9个,因此传统静置越来越难以满足培养要求,以Xuri为例的摆动的反应器培养方式因为更高细胞密度和更短的培养时间,逐步应用到T细胞的生产中,占有比例达到40%以上。
近来,《Current Opinion in Biotechnology》上一篇文章,通过对2002至2017年9月以来所有公布的CAR-T药物生产工艺,综合来看,约有19%的采用抗体IL2联合激活+病毒转染+方瓶扩增的工艺,约有18%的采用抗体IL2联合激活+病毒转染+培养袋扩增的工艺,还有43%的采用抗体磁珠激活+病毒转染+方瓶摆动反应器扩增的工艺,这也体现了在不断探索中前进的CAR-T工艺。
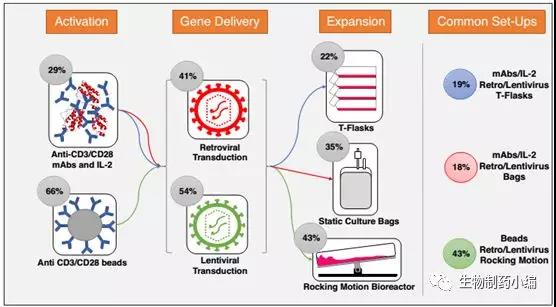
▲ CAR-T药物关键生产工艺概况
然而对于整个CAR-T生产工艺却没有结束,还需要有一系列的质量检测。以CAR-T CD19为例,目前对最终产品外观、安全性、纯度、杂质、鉴定、数量及活性方面进行一系列的控制,药物的T活性要高于70; 21CFR610.12中14天的无菌检测法至少保证第七天仍是阴性;内毒素要求为5 EU /Kg/h;CD19的B细胞含量应低于2%。

▲ CAR-T药物质量控制
自体T细胞疗法的每个产品都是独立批次,为保持CAR-T批间质量一致,对CAR-T生产的每一步实施质量控制十分必要。其中,CAR表达水平作为CAR-T质量控制的重要参数之一,通常通过流式细胞术检测CAR阳性T细胞占总T细胞的比例来评估,即CAR阳性表达率,目前要求为不低于15%。同时必须强调的是所有最终CAR-T药物的剂量都是阳性T细胞来计数的,所以CAR-T细胞的阳性检测十分关键,笔者在此分享几个案例。
案例一、Anti-BCMA CAR表达阳性率检测
案例来源:深圳普瑞金生物药业公司
检测方法:流式细胞术
检测仪器:BD FACSCalibur流式细胞分析仪
样本信息:转染anti-BCMA CAR的人原代T淋巴细胞
主要试剂:
生物素标记的hBCMA蛋白(Biotinylated Human BCMA / TNFRSF17Protein,Fc Tag,Avi Tag(Avitag™),ACROBiosystems,Cat.No.BC7-H82F0);
PE标记的链霉亲和素(PEStreptavidin,Biolegend,Cat.No.405204);
简要流程:
1. 将anti-BCMA CAR基因通过慢病毒质粒转染,整合到来自患者的自体T细胞基因中;
2. 利用anti-BCMA CAR特异性结合BCMA蛋白的特性,将生物素标记的hBCMA蛋白(ACROBiosystems,Cat.No.BC7-H82F0)标记到anti-BCMACAR-T细胞表面;
3. 利用生物素特异性结合亲和素的特性,将PE标记的链霉亲和素(Biolegend,Cat.No.405204) 作为荧光二抗,标记到anti-BCMACAR-T细胞表面;
4. 用BD FACSCalibur流式细胞分析仪进行检测分析。
检测结果:
结果显示1号患者anti-BCMA-CAR T细胞阳性率在52.72%,2号患者anti-BCMA-CART细胞阳性率在73.49%。
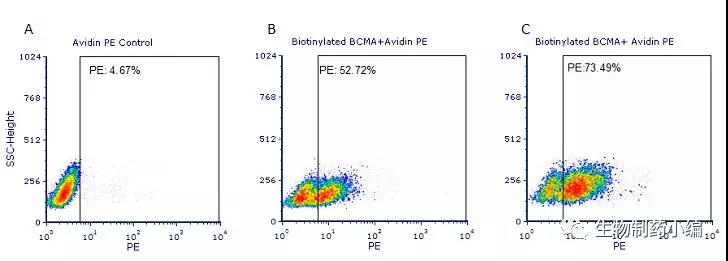
Human T cells were transfected with anti-BCMACAR and cultured for 3 days. Three days post-transfection, 1x10 6 cellswere first incubated with 50ul biotinylated human BCMA protein(Cat.No. BC7-H82F0, 8ug/ml ), washed and then stained with PE Streptavidinand analyzed by flow cytometry. (Data are kindly provided by PREGENE Biopharma)
案例二、Anti-CD19 CAR表达阳性率检测
案例来源:ACRO公司应用开发团队自主研发
检测方法:流式细胞术
检测仪器:NovoCyteTM Flow Cytometer,ACEA Biosciences
样本信息:R1013-C6细胞(过表达Anti-CD19[FMC63]scFv & RFP的Expi 293细胞)
主要试剂:
生物素标记的hCD19蛋白(Biotinylated Human CD19,Fc Tag,ultra sensitivity (primary amine labeling),ACROBiosystems,Cat.No.CD9-H8259);
FITC标记的链霉亲和素(FITC Streptavidin,Biolegend,Cat.No.405201);
简要流程:
1. 将Anti-CD19[FMC63] scFv& RFP基因通过质粒转染,整合到Expi 293细胞基因中,命名为R1013-C6细胞;
2. 利用anti-CD19[FMC63]scFv特异性结合CD19蛋白的特性,将生物素标记的hCD19蛋白(ACROBiosystems,Cat.No.CD9-H8259)标记到R1013-C6细胞表面;
3. 利用生物素特异性结合亲和素的特性,将FITC标记的链霉亲和素(FITC Streptavidin,Biolegend,Cat.No.405201)作为荧光二抗,标记到R1013-C6细胞表面;
4. 用NovoCyteTMFlow Cytometer流式细胞分析仪进行检测分析。
检测结果:
结果显示生物素标记的CD19蛋白能够与 R1013-C6细胞膜表面的anti-CD19 [FMC63]
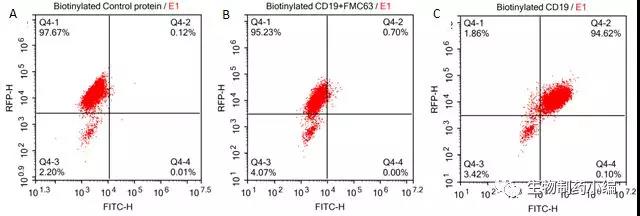
293 cells were transfected with FCM63-scFv andRFP tag. 2x105 of the cells were first incubated with A.Biotinylated protein control. B. Recombinant biotinylated human CD19 (Cat. No.CD9-H8259, 10ug/ml). C. Recombinant biotinylated human CD19 (Cat. No.CD9-H8259, 10ug/ml) and FMC63 (Mouse anti-CD19 antibody), followed by FITCStreptavidin, and then analyzed using NovoCyteTM Flow Cytometer. RFP was usedto evaluate CAR(FMC63-scFv) expression and FITC was used to evaluate thebinding activity of recombinantbiotinylated human CD19 (Cat. No. CD9-H8259).
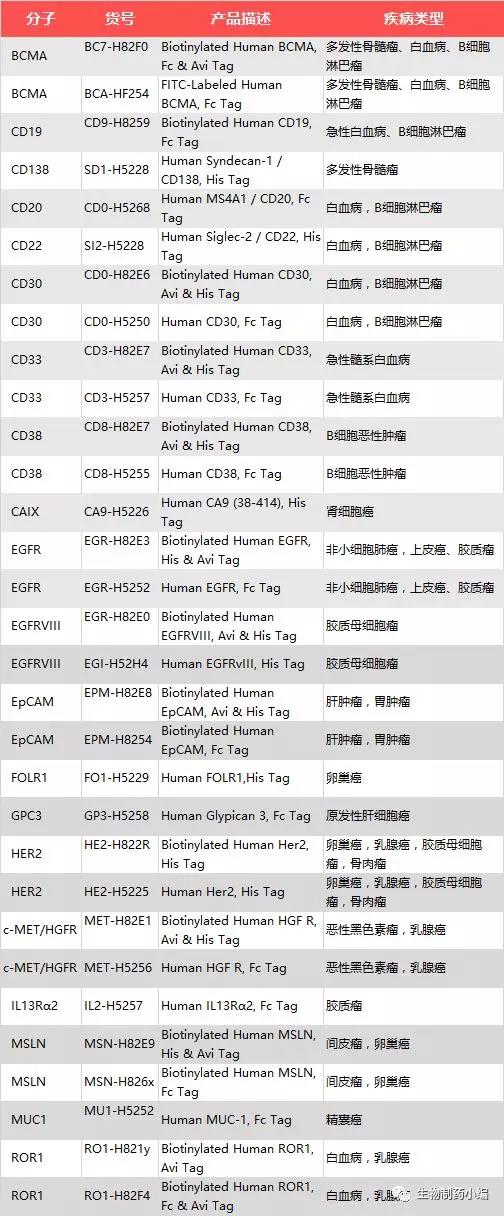
ACROBiosystems作为专注于医药研发领域的蛋白供应商,利用专业的蛋白研发平台和生物素标记平台,开发了一系列CAR-T靶点蛋白,助力CAR-T疗法的开发,其中生物素预先标记的蛋白在Biopanning筛选scFv,以及流式细胞技术检测CAR表达和筛选CAR表达的细胞中独具优势。目前产品已覆盖BCMA,CD19,ROR1,EGFRVIII等20余个CAR-T热门靶点。如果您有其他相关案例分享或者对以下某个案例细节感兴趣,请联系cart@acrobiosystems.com。
ACRO CAR-T靶点蛋白产品列表
展望
CAR-T药物虽然历经几十年的发展,但是工业化的道路近几年才慢慢走通,底子相对还很薄。同时如上所述,基于其转化医学的鲜明特点,其在工业化生产方面仍然还存在不少难点和痛点,挑战重重。但是无论怎样,治病救人,安全质量仍然需要考虑到第一位,必须逐步实现生产的流程标准化和规范化,严格做好CAR-T药物的质量控制。
参考文献
1. Vormittag P, Gunn R, Ghorashian S, et al. A guide to manufacturing CAR T cell therapies[J]. Current opinion in biotechnology, 2018, 53: 164-181.
2. Piscopo N J, Mueller K P, Das A, et al. Bioengineering solutions for manufacturing challenges in CAR T cells[J]. Biotechnology journal, 2017.
3. Siegler S E. Autologous CAR-T Cell Manufacturing: Current Standing and Future Directions. Genetic Engineering & Biotechnology News, 2017.
相关产品
ESCO生物反应器


















